
Novi zakon o zdravilih, ki je začel veljati marca letos, do avgusta 2015 pa naj bi bili sprejeti še povezani podzakonski akti, inženirje, ki se ukvarjajo s celičnim inženirstvom, postavlja v negotov položaj, sej ne vedo, kaj točno prinaša, so opozorili člani društva na okrogli mizi.
Če je bila ta dejavnost, zlasti na področju veterine, dokaj neregulirana, pa nova ureditev prinaša precejšnje zaostritve, ki po mnenju stroke za dejansko delo v mnogih določbah niti nimajo logičnega smisla. Pri tem so izpostavili najbolj ključne. Tako novi zakon med drugim prepoveduje oglaševanje nerutinsko pripravljenih zdravil.
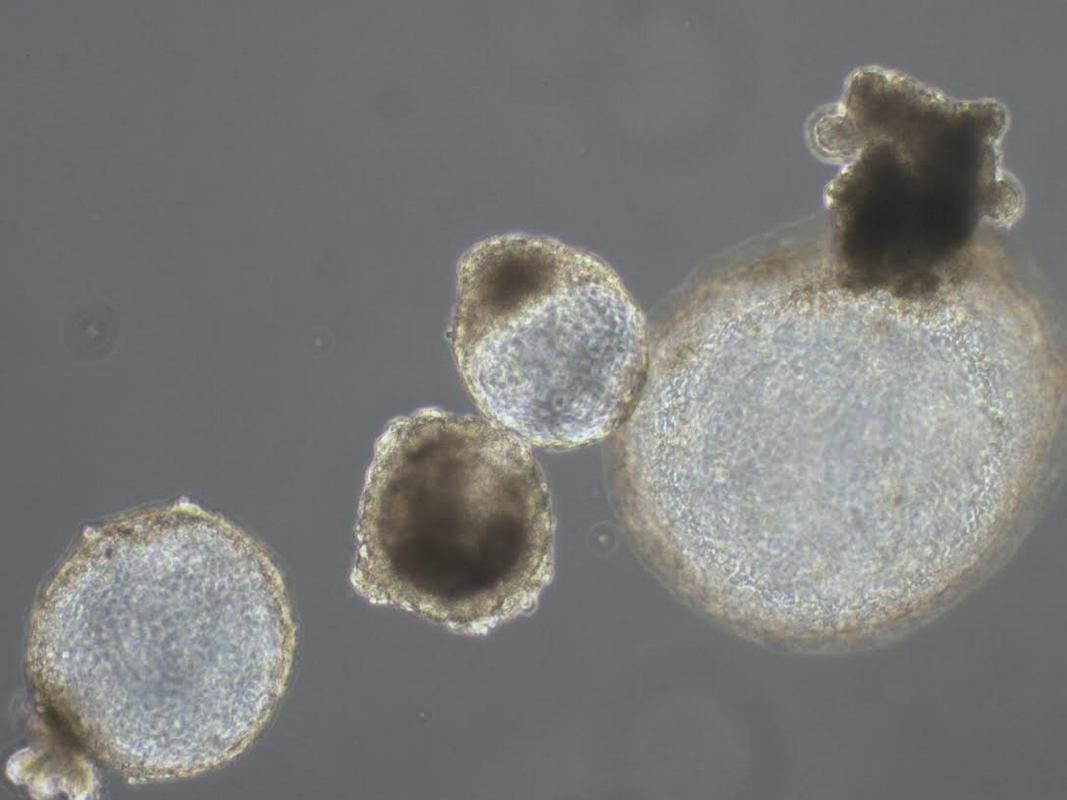
To bi neposredno prizadelo mala biotehnološka podjetja, kot je npr. Animacel, ki se ukvarjajo s celično terapijo za domače živali in ki jim tovrstne napredne metode predstavljajo osnovni posel. V omenjenem podjetju so izpostavili tudi določbo, ki prepoveduje uvoz in izvoz nerutinsko pripravljenih zdravil (gre za zdravila, kjer je ena serija pripravljena za enega samega odjemalca op. a.).
"Naše podjetje se bo prisiljeno preseliti v Avstrijo, če bodo ta zakon izvajali tako, kot je napisan, in res ne vem, ali je namen te države, da visokotehnološka podjetja izganja iz Slovenije," je dejal Gregor Majdič iz Animacela. Obenem se mu nesmiselna zdi določba, ki tudi za veterinarje zahteva zavarovanje v višini 100.000 evrov za primere napak pri zdravljenju, saj je zelo malo verjetno, da bo kdo pri nas zahteval oz. da mu bo dosojena takšna odškodnina za smrt ali poškodbo hišnega ljubljenčka.
Bodo zdravila dajali na slepo srečo?
Prav tako se bodo morali vsi, ki bodo pripravljali tovrstna zdravila, vpisati že v tretji register, velika nejasnost pa je prepoved kliničnih preizkušanj nerutinsko pripravljenih zdravil. Člani društva so pri tem opozorili na to, da ne morejo pridobivati podatkov in posledično izboljševati zdravil, če jih ne smejo klinično preizkusiti. "To tudi pomeni, da bo vsak pacient poskusni zajček," je bilo slišati. Prav tako ni jasno, kaj se bo zgodilo s pripravki, ki se že uporabljajo v kliničnih preizkusih, po novem zakonu pa je njihovo klinično preizkušanje prepovedano.
Ob tem so opozorili, da zakon zahteva tudi previsoke varnostne standarde, ki so sicer smiselni za farmacevtsko proizvodnjo, ne pa za upravljanje s celičnimi kulturami, kjer so razmere popolnoma drugačne. V podjetju Educell, ki izdeluje celične pripravke, pa so poudarili, da njihovi izdelki po novem spadajo pod več zakonov, ne vedo pa tudi, ali bodo morali isto vrsto celic, ki se uporabljajo za dve vrsti zdravljenj, prijaviti dvakrat.
Za konec pa so udeleženci okrogle mize opozorili še na to, da zakon predvideva, da bi morali zdravniki, ki pripravljajo takšna zdravila za svoje bolnike, te tudi prijaviti in dobiti dovoljenje zanje. Pri tem ni jasno, ali bodo morali to storiti za vsakega bolnika posebej. "Na tak način bomo lahko zdravili le prvega bolnika," je bilo cinično pripomnjeno. V društvu bodo zdaj pripravili tudi strokovna izhodišča za prihajajoče podzakonske akte in jih posredovali ministrstvu.
















































 2. sv
2. sv
 Odpikajmo nasilje
Odpikajmo nasilje












Komentarji so trenutno privzeto izklopljeni. V nastavitvah si jih lahko omogočite. Za prikaz možnosti nastavitev kliknite na ikono vašega profila v zgornjem desnem kotu zaslona.
Prikaži komentarje